DB102 (enzastaurin)
有望成为中国创新药企的第一个百亿级“重磅炸弹”
DB102作为一款全球首创新药,将实现全球销售,和国内外差异化定价,以国际市场的销售收益反哺国内市场的医疗支付,真正做出让中国老百姓吃得起的创新药。
国际III期临床,多项中国创举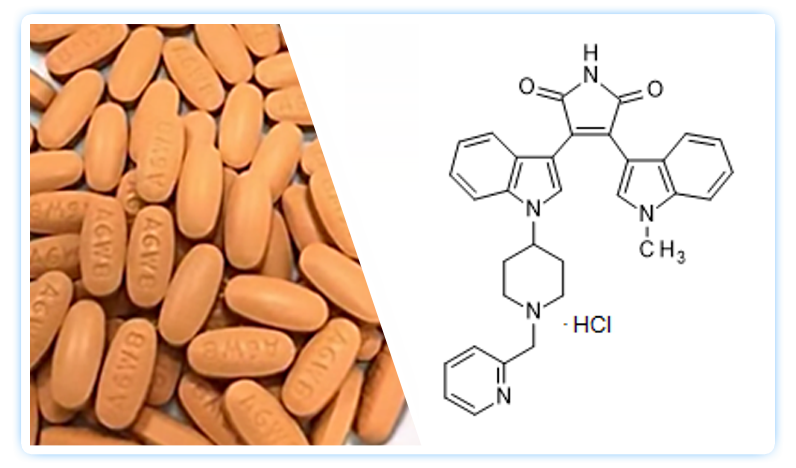
DB102 (enzastaurin)
有望成为中国创新药企的第一个百亿级“重磅炸弹”
DB102作为一款全球首创新药,将实现全球销售,和国内外差异化定价,以国际市场的销售收益反哺国内市场的医疗支付,真正做出让中国老百姓吃得起的创新药。
国际III期临床,多项中国创举
ENGAGE研究:DB102用于一线治疗GBM的国际多中心III期临床试验
ENGAGE研究是全新生物标志物DGM1指导下的一项随机、双盲、安慰剂对照、国际多中心III期临床研究,将入组超过300例新诊断为胶质母细胞瘤(GBM)的患者,将以精准打击全身最恶性的脑胶质瘤。